快訊
- 開戰後一周受益人數逆勢增!小資族搶進10檔ETF出列
- 藍徵召新北、宜蘭、嘉市長參選人 國民黨:週六後藍白協調共推最強人選機制
- 佳世達董座一語動心! 佳世達新總座柯淑芬:想改變把事情做好的態度最動心
- 川習會前最新民調!逾7成中國人視美國為威脅 台灣是最大衝突點
- 沈浸式無人機投彈! 陸軍58砲指部組合訓練 FPV穿梭城鎮追擊敵軍
- 伊朗戰爭衝擊能源供應 日經亞洲:對台灣能源安全的實況壓力測試
- 吳宗憲請辭黨辭參選宜蘭縣長 尹乃菁將接國民黨文傳會主委
- 有片/瑞士小鎮出現地獄巴士 狂徒自焚全車6人活活燒死
- 日本東北大地震15週年 片山和之:盼日台互助互持關係持續
- 欠稅累積286萬還隱匿財產 泰式料理餐廳主廚遭管收
- 【懶人包】 許雅鈞曾爆私生子、會所找姑娘、出賣大S出殯照約妹 8段花邊回顧速掌握
- 中國掀「養龍蝦」AI代理人瘋潮 傳官方下令禁用
- 【一文看懂】許雅鈞是誰?26歲小S帶球嫁 住帝寶、傳家暴、爆花邊!徐熙娣吞忍底線曝光
- 川普「西半球」戰略邁大步 我友邦巴拉圭通過美軍暫駐協定
- 台股收盤飆漲1342點站上3萬4 創史上第2大!台積電收漲1940元
- 王家俊專欄:台灣拚外交「該走出去就出去」! 江啟臣才剛訪澳 卓榮泰錯在哪
- 許雅鈞被爆「大S出殯照私約正妹」 S媽69字怒斥:心術不正
- 巴拿馬接管效應?中國航運巨頭港口營運突喊卡 美中角力升溫
- 遭老鼠藥下毒險死!澳洲男出庭揭蛇蠍女「控制狂」 檢察官爆她老爸「高院法官」
- 檢察總長票選制 檢協會籲納入法院組織法
腸道慢性發炎有解了!清大攜手國發院「成功研發新藥」
2025-01-15 11:09 / 作者 陳泓儒

清華生醫學院助理教授邱于芯(右二)與國衛院生技藥研所所長謝興邦(左二),帶領清華化學系博士生薛雯勻(左一)、生技所碩士生吳苡伶(右一)成功研發出治療慢性腸道發炎新藥。清大提供
由壓力引發的腸道慢性發炎,導致腹瀉、消化不良,幾乎是不少現代人擁有的疾病。不過,此問題現在有解方了!清華大學今(15日)表示,生醫學院助理教授邱于芯與國衛院生技藥研所所長謝興邦組成的生物、化學跨領域研究團隊,找到關閉腸道細胞表面離子通道的機制,成功研發出抑制發炎分子釋放的藥物,為治療帶來新希望。這項研究成果更登上知名國際期刊《先進科學》(Advanced Science)。清大指出,現代人因情緒緊張、飲食不正常等因素,導致慢性腸道發炎病患人數逐年攀升。根據健保署統計,台灣2022年潰瘍性結腸炎盛行率增加到10萬分之19.6;克隆氏症盛行率則約10萬分之8.3。不少患者長期受到腹痛、腹瀉、血便等症狀困擾,嚴重時甚至會造成腸道穿孔。
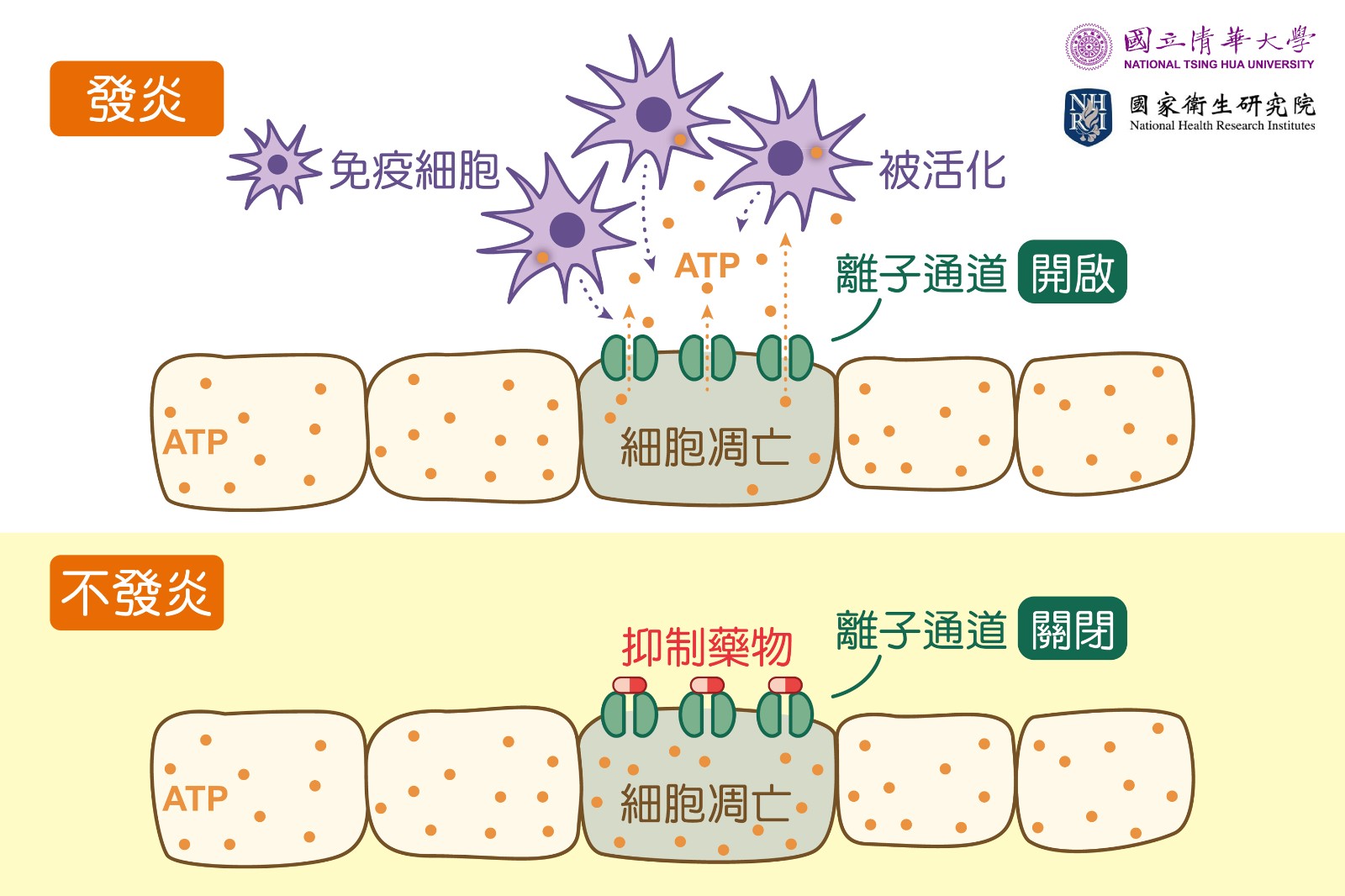
邱于芯指出,「發炎性腸道疾病」是一種免疫失調,成因迄今不明,也無法根治,目前臨床上多半靠消炎藥、類固醇控制,但容易復發。近年雖有新型抑制免疫的生物製劑問世,但治療費用昂貴,不只許多患者無法長期負擔,也增加健保支出。對此,清華與國衛院共同組成的研究團隊,決定另闢蹊徑,研發出新型的小分子藥物。它透過阻止腸道表面黏膜細胞的離子通道打開,令發炎分子跑不出來,成功抑制發炎反應。
邱于芯說明,細胞內有一種稱為ATP的重要能量分子,當腸道細胞受損凋亡時,就會通過大孔徑的PANX1離子通道跑出來,釋放出危險的訊號,吸引免疫細胞過來清理受損的細胞。她解釋:「這原本是身體清除受損細胞的修復機制。但在發炎性腸道疾病中,這個離子通道會持續開啟,不斷釋放ATP,導致越來越多的免疫細胞被召集到腸道,引發炎症,形成惡性循環,最終造成更嚴重的腸道傷害。」
清華大學生醫學院助理教授邱于芯與國衛院生技藥研所長謝興邦組成生物、化學跨領域研究團隊找到關閉腸道細胞表面離子通道的機制,成功研發出抑制發炎分子釋放的藥物。清大提供
這也讓邱于芯去思考,若能關閉離子通道、不讓引發反覆發炎的分子跑出來,或許就能關上「潘朵拉的盒子」,為治療慢性腸道發炎提供解方。事實上,邱于芯10年前與澳洲研究團隊合作時,就曾研發出一款能關閉PANX1離子通道的藥物,但當時藥物有肝毒性的副作用。此次透過清華與國衛院的雙邊合作計畫,與專精藥物化學的國衛院特聘研究員謝興邦、研究員李靜琪合作,改良了舊藥的分子結構,效果更好,也解決了肝毒性的問題。
畢業自清大化學系及化學所的謝興邦,也是清華化學系合聘教授,他認為「開發新藥就像為鎖具打造一把對的鑰匙。」謝興邦領導的研究團隊透過化學修飾,在藥物分子結構中增加一個碳原子的距離,加大空間以供立體旋轉,改變了會造成肝毒性的平面結構,且藥效更好。邱于芯補充:「新藥的重要突破在,僅專一作用於關閉離子通道蛋白,而不會影響到其他的蛋白質,因此效果好又安全。」
邱于芯進一步指出,研發出關閉PANX1離子通道的新藥,就像掌握了一把控制細胞發炎的新鑰匙,未來能繼續研發治療其他發炎性疾病的新藥,如腦中風、癲癇、慢性疼痛、氣喘、過敏,甚至心臟衰竭等,可望為組織損傷、免疫相關疾病帶來新的治療契機。
這項花了近3年的研究,由清華化學系博士生薛雯勻負責新藥的化學合成與改良,清華生技所碩士生吳苡伶進行藥物活性檢測,從100多種化合物中篩選出64個,再進行深入研究。清華生醫學院教授呂平江則運用電腦模擬技術,驗證了藥物與蛋白質的作用機制。研究團隊同時也特別感謝台大新竹分院醫師翁孟慈與台大醫院醫師魏淑鉁,協助進行動物實驗,證實新藥能有效改善腸道發炎、血便等症狀;及澳洲樂卓博大學教授普恩(Ivan Poon)團隊的研究合作。

國衛院生技藥研所所長謝興邦(右)指導博士生薛雯勻操作流式細胞儀。清大提供
最新more>
- WBC》美國棒球再次偉大踢鐵板 墨義對戰2度9局出現大分逆轉
- 開戰後一周受益人數逆勢增!小資族搶進10檔ETF出列
- 藍徵召新北、宜蘭、嘉市長參選人 國民黨:週六後藍白協調共推最強人選機制
- 佳世達董座一語動心! 佳世達新總座柯淑芬:想改變把事情做好的態度最動心
- 濟州島海岸又見「茶包毒品」漂上岸!疑來自台灣 已是第18起
- 噁!基隆廟口夜市巷弄「滿地油汙卡溝」 遊客臭到不敢走…公所清不完
- 川習會前最新民調!逾7成中國人視美國為威脅 台灣是最大衝突點
- 沈浸式無人機投彈! 陸軍58砲指部組合訓練 FPV穿梭城鎮追擊敵軍
- 國民黨正式徵召李四川選新北 黃國昌競辦:將持續提具體可行政見
- 伊朗戰爭衝擊能源供應 日經亞洲:對台灣能源安全的實況壓力測試
熱門more>
- 高雄摩鐵命案!21歲的她泡澡成了「浴缸女屍」 男友也在房間內
- 台版「寄生上流」!男換鎖「偽造租約」爽住套房3年 屋主開門傻眼
- WBC》資格賽晉級隊伍唯一2勝 2030經典賽台灣直升會內賽
- 差點逃不了!伊朗女足「一個國際手勢」求救 澳警秘密載往安全地點
- 英國考慮派出航空母艦支援中東 川普:免來,我們不需要打贏才參戰的傢伙
- 台灣隊首支滿貫砲!「費仔」費爾柴德新婚4個月 老婆絕美婚紗照曝光
- 韓「摩鐵連環殺人案」20歲女嫌真容曝 犯案前先諮詢ChatGPT
- 「老師以為我失蹤了」 台旅客機票改4次、滯留中東5天終得返
- 【一文看懂】WBC台韓澳同為2勝2敗 為何南韓取得邁阿密8強門票?
- 黑心診所殺嬰牟利14億!南韓妙齡女懷孕36週「墮胎」 驚爆診所凍死活嬰

