- 愛子被蛇蠍女下毒險死!澳洲男父母揭她心機重 連「私人瀏覽紀錄」都掌握
- 美軍P-8A巡邏機飛越台灣海峽 展現對印太承諾
- 伊朗戰爭前最後數據 美國2月通膨維持在2.4%
- 一天連三艘貨輪在荷姆茲海峽遇襲! 泰國輪起火燃燒3失蹤
- 【更新】掃公園10餘年!清潔婦冒名申請代賑工 女技士疑放水圖利遭搜索
- WBC》晉級還沒絕望美媒先揪戰犯 美國隊長賈吉入列
- 中國全國政協閉幕 王滬寧強調中共領導
- 【一文看懂】伊朗NOPO什麼來頭?精銳反恐部隊「營救人質、鎮壓抗議、保護領導人」
- 伊朗戰爭點燃航運漲價潮 MSC海運宣布16日起緊急加徵燃油附加費
- 台南火災!連燒7間鐵皮屋「2月才被毒駕撞」 機車行夫妻成焦屍
- 【更新】印股票換鈔票、假交易3年騙了5.3億 銀泰佶負責人林室融羈押禁見
- 遭蛇蠍女下毒誤傷「台灣小吃」!律師代澳洲男致歉:他們很開心能再來台灣
- 水價檢討遇上黑天鵝!漲價仍無時間表 台水董座:賣1度水虧逾3元 恐連虧4年
- 伊朗新領導人行蹤成謎 以伊官員:他雙腿被炸傷、黑衣特種部隊保護中
- 大阪鬧區「從馬路竄出」13公尺鐵柱 市府致歉:下水道施工意外
- 手指比「3」辯「OK」!藍委廖先翔父親收賄阻拆違建 更一審改判理由曝光
- 台股股王信驊收盤炸裂奔萬元 10檔千金股漲停、37檔千金股閃耀登場
- 慧榮 Embedded World展 大秀 AI 最佳化開機儲存與企業級方案
- 游智彬丟雞蛋影片曝光!驚險25秒「衝車陣擲蛋、8警撲上前壓制」
- 【更新】逃亡10年!「菲律賓販千萬毒品被關」 80歲毒梟今押解返台歸案
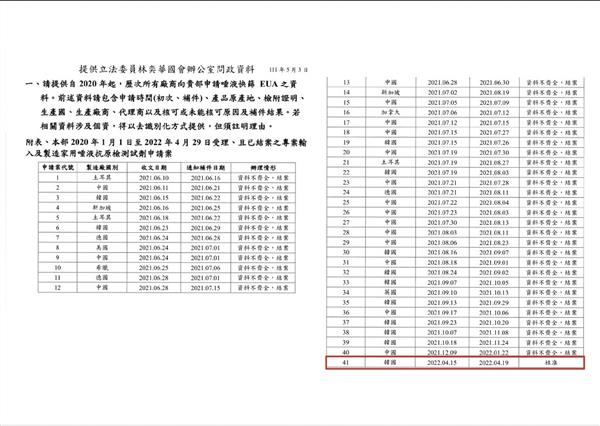
去年40家唾液快篩送件遭拒 國民黨質疑「獨厚」福又達獲取利潤45億
(更新:陳時中回應)
食藥署日前核准高端疫苗大股東「福又達生物科技股份有限公司」,「獨家」進口唾液快篩試劑,引發質疑。國民黨立法院黨團今(5月11日)指出,自去年6月起高達40件唾液快篩申請案,且至少有3家廠商申請引進與福又達同款的試劑廠牌,皆被駁回,僅福又達在提出申請後兩周內火速通過,質疑內藏「綠色通道」,要求衛福部長陳時中說明,也籲檢調徹查。
對此,陳時中在下午疫情記者會說明,對於福又達唾液快篩售價,尊重自由市場,除非政府徵用才有公定價格,否則市場是買賣關係,現今取得快篩管道相對多元,價格不合理就不要買。至於被質疑是圖利特定廠商,陳時中要求國民黨拿出證據,否則對公務體系不公平。
質疑一:40件駁回,福又達為何能成為「唯一」核准?
國民黨立委林奕華指出,陳時中於4月22日時公開表示尚未收到唾液快篩進口申請案,但實際上卻是自去年6月起,多家台灣廠商提出高達40次的進口申請,皆被食藥署以「資料不齊全」結案駁回。反觀福又達在今年4月15日提出申請韓國Gmate唾液快篩進口,29日即審查通過。經查,去年也有4家廠商申請進口Gmate唾液快篩,但被駁回。
質疑二:衛福部核准理由不見國內檢測結果
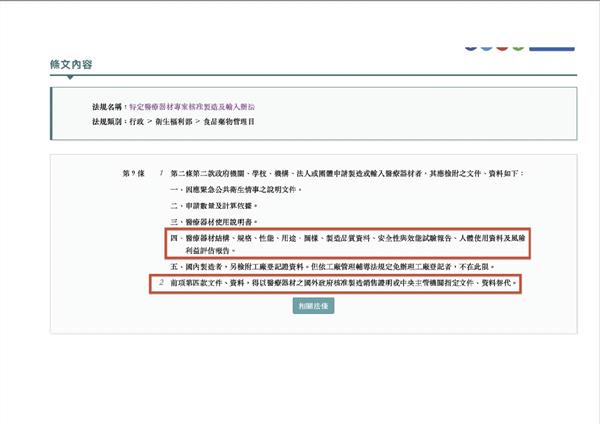
國民黨團發函詢問准駁依據?衛福部回函表示,Gmate今年2月已在澳洲上市,福又達以「澳洲已經核准該快篩EUA(緊急授權)」為證明。林奕華卻質疑,陳時中曾指稱福又達率先獲准原因在於「4月26日已請福又達提供國內檢驗機構的驗證報告」,據她瞭解,衛福部確實曾協助福又達,委請長庚醫院針對Gmate進行100人檢驗測試,但當國民黨團進一步詢問,衛福部對國內檢驗報告「閉口不談」,反而以澳洲EUA為證明理由,令人質疑是否國內檢測報告數字不夠好?
質疑三:福又達僅提供澳洲EUA,未有製造國核准證明
林奕華又質疑,長期以來指揮中心堅持廠商進口快篩試劑,必須在台灣進行測試後再審核,為何福又達申請進口就可以「澳洲EUA」作為核准理由?其他廠商申請也能一體適用嗎?且,其他廠商也能如福又達一樣,獲得協助委請國內醫院進行臨床測試嗎?
不僅如此,食藥署對進口篩劑檢驗要求另一項為「製造國的准許製造相關證明文件」,林奕華指出,福又達未取得韓國核發的製造證明文件,去年申請Gmate快篩進口案,正因拿不到韓國出具的生產證明文件而被打回票,為何如今福又達也拿不到,卻能獲准進口呢?這是指揮中心在護航、包庇「開闢綠色通道」嗎?呼籲檢調應該啟動調查。
質疑四:粗估福又達利潤高達45億元,這是圖利特定廠商?
國民黨立委林德福也指出,福又達申請進口的Gmate唾液快篩試劑數量是3000萬劑,外傳每劑成本不到新台幣40元,Gmate唾液快篩在馬來西亞每劑大約賣新台幣100元,福又達卻將在台灣賣230元,評估每劑獲利扣掉成本可達150元。以3000萬劑計算,利潤高達45億,「比高端賣給政府500萬劑疫苗獲利40億還更賺。」
- MissAV被新北市政府封鎖 老司機崩潰:又不是商業片
- WBC》棒球數學題圖解!2張圖看清美墨義晉級情境
- 愛子被蛇蠍女下毒險死!澳洲男父母揭她心機重 連「私人瀏覽紀錄」都掌握
- 最強演唱會阿北!周杰倫、BP、TWICE都有他 真實身分曝…網友跪一片
- 美軍P-8A巡邏機飛越台灣海峽 展現對印太承諾
- 伊朗戰爭前最後數據 美國2月通膨維持在2.4%
- 被棒球耽誤的畫家!莊陳仲敖曬畫作「把WBC的回憶放進畫裡」球迷狂讚
- 一天連三艘貨輪在荷姆茲海峽遇襲! 泰國輪起火燃燒3失蹤
- 311滿15年!祖母被台灣搜救隊救出 日男連13年送蛋包飯謝恩
- 【更新】掃公園10餘年!清潔婦冒名申請代賑工 女技士疑放水圖利遭搜索
- 高雄摩鐵命案!21歲的她泡澡成了「浴缸女屍」 男友也在房間內
- 台版「寄生上流」!男換鎖「偽造租約」爽住套房3年 屋主開門傻眼
- WBC》資格賽晉級隊伍唯一2勝 2030經典賽台灣直升會內賽
- 差點逃不了!伊朗女足「一個國際手勢」求救 澳警秘密載往安全地點
- 荷姆茲海峽異象!「百船內陸群聚、海上排圓陣」GPS全都失靈
- 英國考慮派出航空母艦支援中東 川普:免來,我們不需要打贏才參戰的傢伙
- 台灣隊首支滿貫砲!「費仔」費爾柴德新婚4個月 老婆絕美婚紗照曝光
- 黑心診所殺嬰牟利14億!南韓妙齡女懷孕36週「墮胎」 驚爆診所凍死活嬰
- 韓「摩鐵連環殺人案」20歲女嫌真容曝 犯案前先諮詢ChatGPT
- 才熬20年地下化又來高鐵!高雄居民憂生活、生意再受衝擊